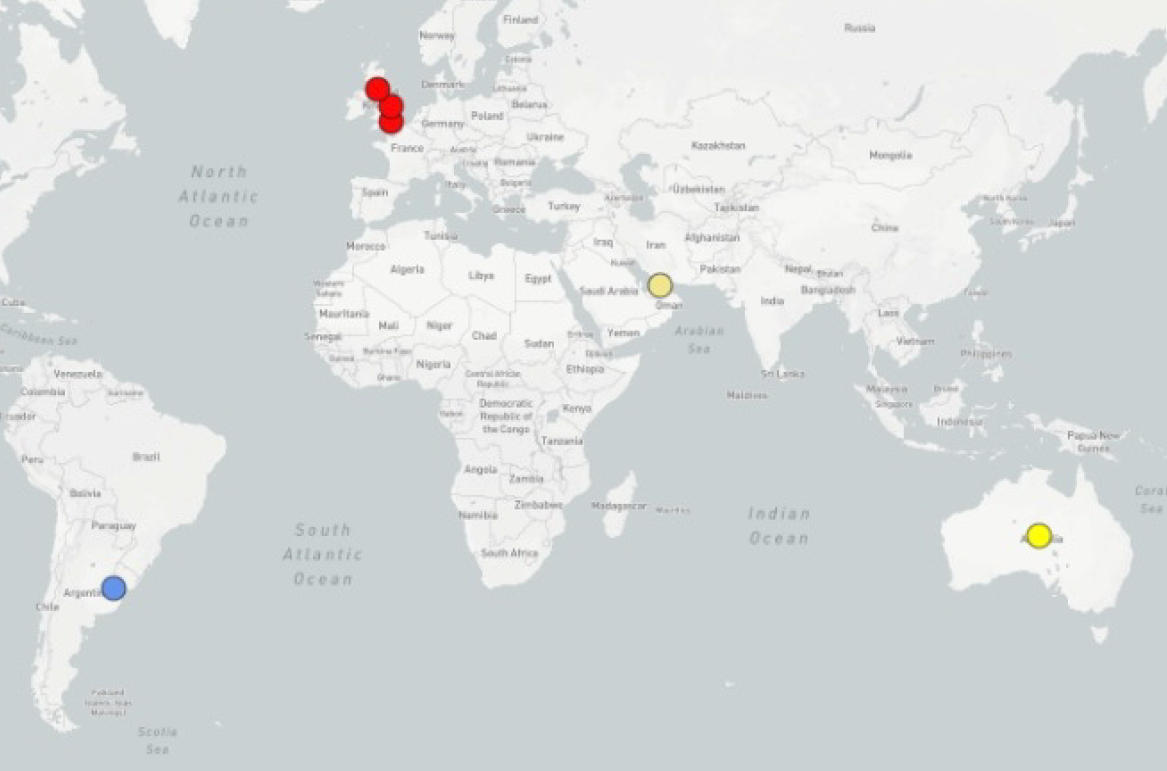
Konie podróżują po całym świecie, w ramach zawodów, wystaw i sprzedaży, co zwiększa ryzyko przenoszenia chorób zakaźnych pomiędzy krajami. Ostatnio opracowano globalny system, który umożliwia genomowy nadzór nad S. equi subsp. equi – zbadano 670 izolatów z 19 krajów. Projekt badawczy podkreślił ogrom skali szerzenia się zakażeń S. equi subsp. equi na całym świecie oraz istotność bioasekuracji, badań diagnostycznych i szczepień w zapobieganiu rozprzestrzeniania się choroby. W badaniu zidentyfikowano 6 grup S. equi subsp. equi (grupy w badaniu BAPS). Stwierdzono, że w Europie dominuje grupa BAPS-2.4