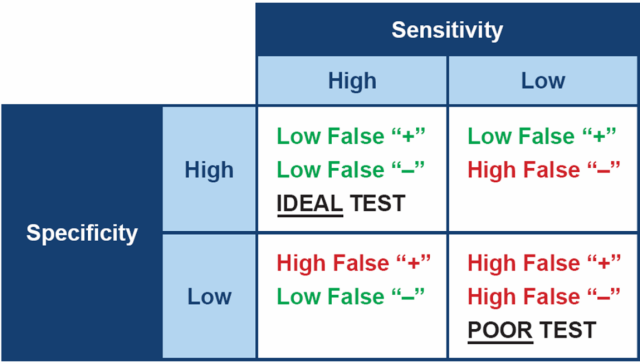
Jeśli przeprowadzasz badania w kierunku jakiejkolwiek choroby, najlepiej wybrać badanie, które będzie cechowało się zarówno wysoką swoistością, jak i czułością. W praktyce, badanie z wysoką czułością pozwala wykryć chore zwierzęta, jednocześnie dając niewiele wyników fałszywie ujemnych. Badanie z wysoką swoistością daje wynik pozytywny u zwierząt, które rzeczywiście są chore, dlatego pojawia się niewiele wyników fałszywie dodatnich.
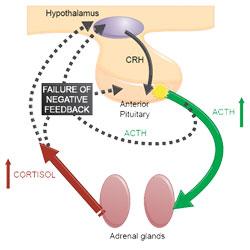
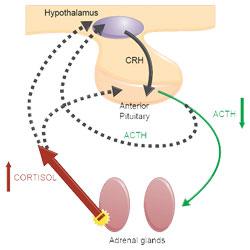
Jednakże nie istnieje test w kierunku zespołu Cushinga posiadający jednocześnie wysoką czułość i swoistość - wszelkie stanowią kompromis pomiędzy tymi dwoma cechami. To oznacza, że badania, które mamy możliwość wykonać przy podejrzeniu hiperkortyzolizmu u psów, muszą zostać użyte w połączeniu, aby mieć pewność postawionego rozpoznania.
(Uwaga – podane poniżej wartości procentowe czułości i swoistości powinny być traktowane jako przybliżone i są reprezentatywne dla wielu badań naukowych w tym temacie. Autor odnosi się do badania Bennaim et al., 2019, w celu uzyskania dalszych informacji).
Test stymulacji ACTH (ACTHST):
Wysoka swoistość (90%), umiarkowana czułość (85% PDH, 50% ADH).
Wyniki fałszywie dodatnie są rzadziej spotykane. Wyniki fałszywie ujemne są częściej spotykane.
Test hamowania niską dawką deksametazonu (LDDST):
Umiarkowana swoistość (70%), wysoka czułość (95%).
Wyniki fałszywie dodatnie są częściej spotykane. Wyniki fałszywie ujemne są rzadziej spotykane.
Stosunek kortyzolu do kreatyniny w moczu (UCCR):
Słaba swoistość (20%), wysoka czułość (97%).
Wyniki fałszywie dodatnie są częste. Wyniki fałszywie ujemne są rzadko spotykane.
Gdy interpretujesz którekolwiek z tych badań, warto wziąć pod uwagę wartość predykcyjną dodatnią i ujemną. Wartość predykcyjna dodatnia (PPV) to odsetek psów z wynikiem dodatnim, które faktycznie mają Cushinga. Wartość predykcyjna ujemna (NPV) to odsetek psów z wynikiem ujemnym, które rzeczywiście nie są chore.
Wartości predykcyjne dodatnie i ujemne biorą pod uwagę zarówno badanie, jak i populację badaną. Jeśli zastosujesz badanie w dwóch populacjach z różną prewalencją choroby, wartości predykcyjne będą różne. W związku z tym PPV i NPV będą się różnić w zależności od częstotliwości wykonywania testów.
- Gdybyśmy badali niemal każdego pacjenta, którego spotykamy (populacja o niskiej prewalencji - 5%)
|
Test
|
Wartość predykcyjna dodatnia
|
Wartość predykcyjna ujemna
|
|
ACTHST (PDH)
|
30%
|
99%
|
|
ACTHST (PDH)
|
24%
|
98%
|
|
LDDST
|
16%
|
100%
|
W tym scenariuszu, jeśli zastosujemy LDDST, możemy być 100% pewni, że wynik ujemny jest prawdziwie ujemny. Jednakże, tylko 16% z uzyskanych wyników dodatnich faktycznie będzie oznaczało zespół Cushinga.
- Gdybyśmy byli bardziej krytyczni z pacjentami, których poddajemy badaniu (populacja o wysokiej prewalencji - 90%)
|
Test
|
Wartość predykcyjna dodatnia
|
Wartość predykcyjna ujemna
|
|
ACTHST (PDH)
|
99%
|
33%
|
|
ACTHST (PDH)
|
98%
|
16%
|
|
LDDST
|
97%
|
62%
|
W tym scenariuszu, jeśli zastosujemy LDDST, 62% wyników ujemnych będzie prawdziwie ujemnych a 97% wyników dodatnich będzie oznaczało zespół Cushinga.
Wniosek
W konsensusie ACVIM z 2012 r. (Behrend et al., 2013) uznano test hamowania niską dawką deksametazonu (LDDST) jako przesiewowy test z wyboru w zespole Cushinga, chyba że podejrzewa się postać jatrogenną. Ze względu na niższą czułość testu stymulacji ACTH, jego użyteczność diagnostyczna, jako testu przesiewowego w kierunku spontanicznie występującego zespołu Cushinga, jest mniejsza niż LDDST.
Jednakże, przy wyborze badania ważne jest także wzięcie pod uwagę innych czynników jak: dostępność, koszt czy choroby współistniejące u pacjenta. Równie ważne jest poprawienie potencjalnego wyniku badania poprzez zapewnienie wysokiego wskaźnika podejrzenia choroby przed wykonaniem testów potwierdzających.